Ursprung des Lebens entdeckt? Forscher rekonstruieren frühesten Stoffwechsel auf der Erde
Vor vier Milliarden Jahren herrschten auf dem Planeten extreme Bedingungen – völlig ohne Sauerstoff. Wovon haben sich also die ersten Mikroorganismen ernährt? Dieser Frage sind nun Forscher der Universität Regensburg und der Ludwig-Maximilians-Universität München nachgegangen.

Vor vier Milliarden Jahren war die Erde heiß und von Vulkanismus geprägt. Die Atmosphäre enthielt keinen Sauerstoff, sondern giftige Gase wie Kohlendioxid und Methan – auch Wasserdampf, durch dessen Abkühlung sich erste Ozeane bildeten. In einem bemerkenswerten Experiment haben Forscher nun hydrothermale Umgebungen simuliert, sogenannte Schwarze Raucher, die möglicherweise die Wiege des Lebens darstellen.
Die Wissenschaftlerinnen und Wissenschaftler der Universität Regensburg und der Ludwig-Maximilians-Universität München sind der Frage nachgegangen, ob die chemischen Prozesse in extremen Umgebungen ausreichten, um den Stoffwechsel frühester Lebensformen zu ermöglichen. Die Ergebnisse wurden in der Fachzeitschrift Nature Ecology & Evolution veröffentlicht.

Konkret untersuchte das Team um Mikrobiologin Prof. Dr. Dina Grohmann vom Deutschen Archaeenzentrum und den Geologen Prof. Dr. William Orsi, ob der Wasserstoff, der bei der Reaktion von Eisen- und Schwefelverbindungen entsteht, ausreicht, um urtümliche Mikroorganismen, die sogenannten methanogenen Archaeen, mit Energie zu versorgen.
– Dr. Robert Reichelt vom Deutschen Archaeenzentrum
Im Labor entstanden dafür sogenannte Chemical Gardens. Das sind Miniaturmodelle hydrothermaler Quellen, bei denen schwefelhaltige (sulfidische) Flüssigkeiten in eisenhaltige Lösungen eingebracht werden. Es bildeten sich schwarze Eisensulfid-Membranen – darunter die Mineralien Mackinawit (FeS) und Greigit (Fe₃S₄) –, und es wurde Wasserstoffgas freigesetzt. Dieser Wasserstoff ist für Mikroorganismen eine potenzielle Energiequelle.
Energiegewinnung aus Wasserstoff
Im Mittelpunkt der Untersuchung stand ein Archaeon namens Methanocaldococcus jannaschii – der Mikroorganismus wurde hydrothermalen Tiefsee-Sedimenten entnommen. Das Archaeon gilt als Modellorganismus für den sogenannten Acetyl-CoA-Stoffwechselweg, eine der ältesten bekannten biochemischen Strategien zur Energiegewinnung aus Wasserstoff und Kohlendioxid.
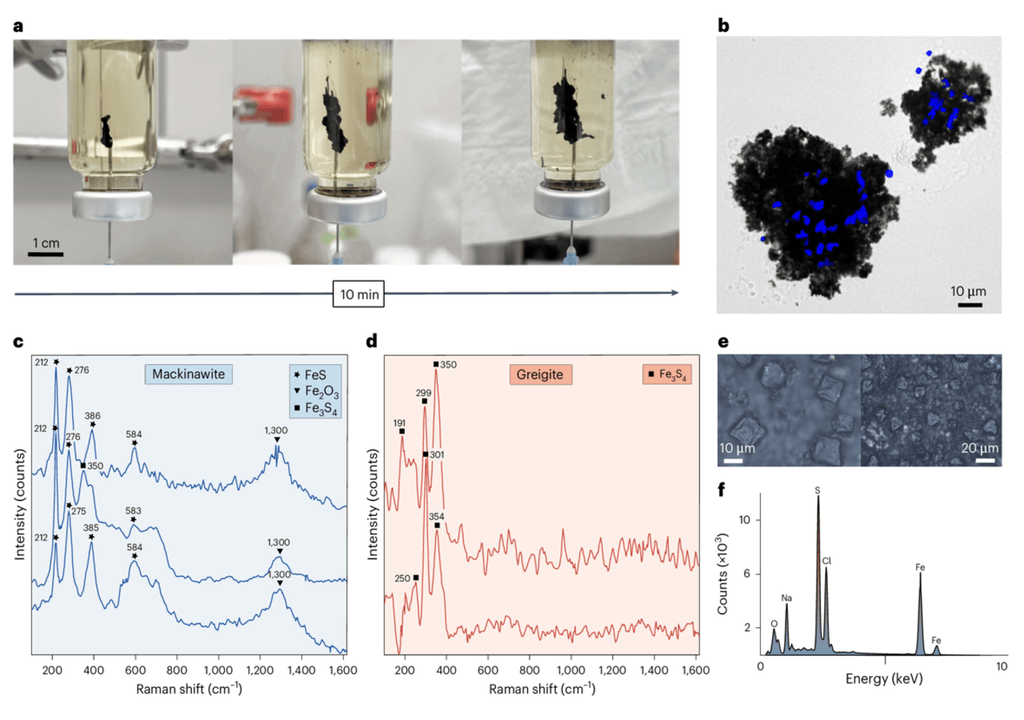
Solche Archaeen sind extrem sauerstoffempfindlich: Bereits geringste Mengen an Sauerstoff können sie abtöten. Die Forschenden schufen deshalb vollständig sauerstofffreie Bedingungen, um ein realistisches Bild der frühen Erde zu simulieren.
– Vanessa Helmbrecht, Erstautorin der Studie
Die Mikroorganismen hielten sich in direkter Nähe zu den Eisensulfid-Partikeln auf. Dieser Umstand passt auch zu den geologischen Funden, denn einige fossile Spuren mikrobiellen Lebens wurden ebenfalls in der Nähe solcher Mineralien entdeckt.
Ausreichend Energie für frühes Leben
Die Studie legt nahe, dass einfache chemische Reaktionen, besonders die Ausfällung von Eisen- und Schwefelverbindungen, bereits ausreichend Energie geliefert haben könnten, um frühe mikrobielle Lebensformen zu ermöglichen. Daraus ergibt sich die Annahme, dass der auf Wasserstoff basierende Acetyl-CoA-Stoffwechsel die evolutionär älteste bekannte Form der Energiegewinnung darstellt.
Die Veröffentlichung ist auch für die Evolutionstheorie bedeutend: Der Ursprung des Lebens auf der Erde könnte somit in der Interaktion einfacher anorganischer Verbindungen in extremen Umgebungen liegen, ganz ohne Beteiligung komplexer organischer Moleküle oder Enzyme.
Die Studie zeigt, wie Leben auf der Erde entstanden sein könnte. Darüber hinaus könnte sie auch für die Suche nach außerirdischem Leben von Nutzen sein. Denn ähnliche geochemische Prozesse könnten auch auf anderen Himmelskörpern stattfinden, etwa auf dem Saturnmond Enceladus oder dem Jupitermond Europa, wo ebenfalls hydrothermale Aktivität vermutet wird.
Quellenhinweis:
Helmbrecht, V., Reichelt, R., Grohmann, D. et al. (2025): Simulated early Earth geochemistry fuels a hydrogen-dependent primordial metabolism. Nature Ecology & Evolution, 9, 769–778.