Burger aus dem Labor: Durchbruch bei der Herstellung von künstlichem Rindfleisch
Müssen künftig keine Tiere mehr geschlachtet werden, um Fleisch zu erzeugen? Ein Forscherteam an der ETH Zürich hat nun erstmals voluminöse, funktionsfähige Rindermuskelfasern im Labor gezüchtet. Damit rückt die Vision vom kultivierten Steak ohne Tierleid ein Stück näher.

Ein Burger ohne Stall, ohne Schlachthof und ohne schlechtes Gewissen – das ist das langfristige Ziel von Wissenschaftlern weltweit. Einem Schweizer Forschungsteam ist nun ein entscheidender Durchbruch gelungen, indem sie aus Vorläuferzellen, sogenannten Myoblasten, erstmals Muskelfasern gezüchtet haben, die echten Rindermuskeln in ihrer Struktur stark ähneln.
Damit gehört das Labor von Ori Bar-Nur, Professor für Regenerations- und Muskelbiologie an der ETH Zürich, zu den ersten Forschungseinrichtungen weltweit, denen es gelungen ist, kultiviertes Rindfleisch mit authentischer Textur herzustellen. Probiert hat der Professor das künstlich gewachsene Fleisch allerdings noch nicht, da in der Schweiz dafür die rechtlichen Grundlagen fehlen.
Doch das Feedback von Kollegen, die im Rahmen genehmigter Verkostungen Laborfleisch testen durften, ist vielversprechend. Der Geschmack und das Mundgefühl seien ähnlich wie echtes Fleisch. „Letztlich ist es auch Rindfleisch – nur dass keine Kuh dafür geschlachtet werden muss“, so Bar-Nur.
Aus Filetstücken gewonnen
Die Grundlage für das Laborfleisch bilden Myoblasten, die entweder aus Biopsien bei lebendigen Kühen oder wie in der aktuellen Studie aus Fleischstücken wie Filet oder Bäckchen gewonnen werden. Die Herausforderung bisher war, dass kultivierte Muskelfasern häufig sehr dünn waren und sich nicht wie natürliche Muskeln zusammenzogen.
Genau dieses Problem wurde nun gelöst. Das Team verwendete dazu einen molekularen Cocktail, der aus Stoffen bestand, die gezielt die Differenzierung der Zellen fördern. Die Substanzen wurden dem Zellkulturmedium, also der nährstoffreichen Lösung, in der die Zellen wachsen, hinzugefügt. Bar-Nur hatte den Cocktail ursprünglich während seiner Zeit an der Harvard University entwickelt, wo er an Muskeltherapien für genetische Krankheiten arbeitete.
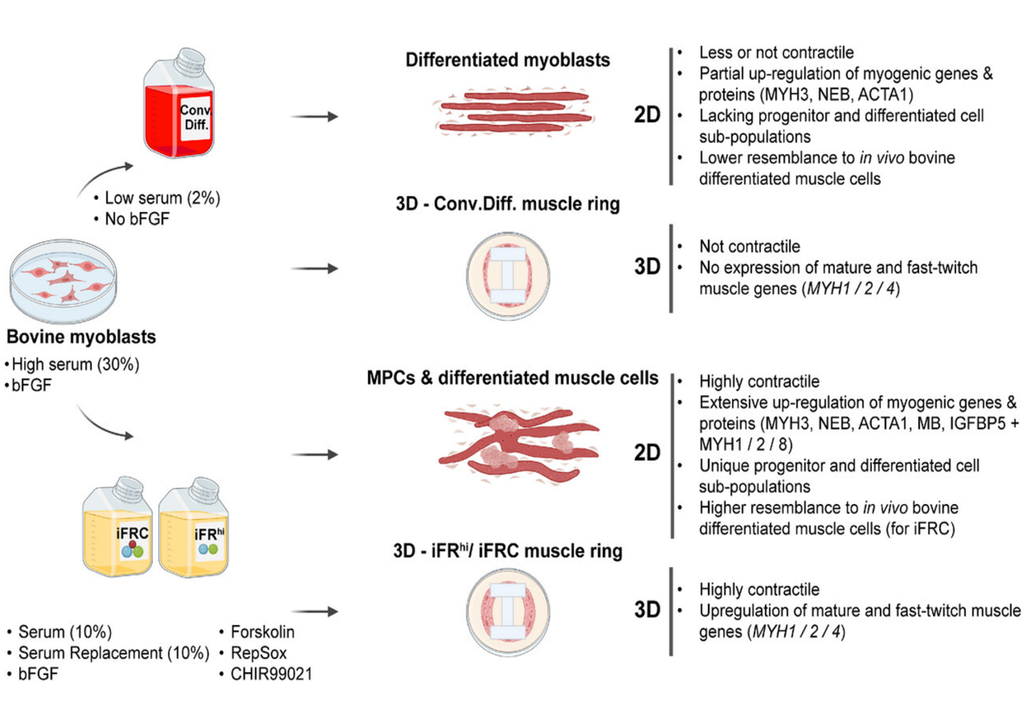
Ein positiver Nebeneffekt war, dass die künstlich hergestellten Muskelfasern nun dieselben Gene und Proteine wie natürliches Muskelgewebe enthalten und darüber hinaus auch funktional sind, das heißt, sie können sich wie echte Muskeln zusammenziehen. Das war bei bisherigen Experimenten nicht der Fall, da den Zellen oft die nötigen Proteine fehlten.
Fleisch für alle?
Der Erfolg könnte die Entwicklung von kultiviertem Rindfleisch deutlich beschleunigen. Während in Singapur bereits gezüchtetes Pouletfleisch im Supermarkt erhältlich ist, hinkt Rindfleisch technologisch hinterher. Bar-Nurs Herstellungsmethode könnte das ändern, doch die Hürden bis zum Marktantritt sind hoch.
– Christine Trautmann, Doktorandin im Labor für Regenerations- und Muskelbiologie, ETH Zürich, eine der Hauptautorinnen der Studie
Auch die Skalierung der Produktion ist eine offene Herausforderung, denn bisher ist es nur gelungen, wenige Gramm Fleisch zu produzieren.

Zudem müssen alle Zutaten, darunter auch der eingesetzte Molekülcocktail, aus dem Endprodukt entfernt werden. Das sei jedoch nicht problematisch, sagt Bar-Nur, weil die betreffenden Moleküle nur im Frühstadium des Wachstumsprozesses benötigt werden und sich später eliminieren lassen.
– Adhideb Ghosh, Wissenschaftler im Labor für Regenerations- und Muskelbiologie, ETH Zürich, Mitautor der Studie
Um die Technologie schneller zur Marktreife zu bringen, denkt Bar-Nur bereits über ein eigenes Start-up nach. Seine Vision: „ethisch unbedenkliche Burger, die erschwinglich und sicher sind.“ Damit könnte das Laborfleisch eines Tages zur echten Alternative für alle werden, die Fleisch mögen, aber nicht auf Kosten von Tierwohl und Umwelt essen wollen.
Quellenhinweis:
Trautmann, C. L., Ghosh, A., Kalkan, A. K., Noé, F., Bar-Nur, O. (2025): Enhanced media optimize bovine myogenesis in 2D and 3D models for cultivated meat applications. Advanced Science.